Maculopatia miopica AntiVEGF
Lucentis® (ranibizumab) primo anti-VEGF approvato dalla Comunita' Europea per il trattamento della neovascolarizzazione coroideale miopica
- Ranibizumab è la prima terapia autorizzata per il miglioramento della vista nei pazienti con riduzione della capacità visiva causata da neovascolarizzazione coroideale secondaria a miopia patologica (CNV miopica)
- Lo studio pivotale mostra un miglioramento medio dell’acuità visiva fino a un massimo di 14 lettere dopo un anno, con una mediana di due sole iniezioni
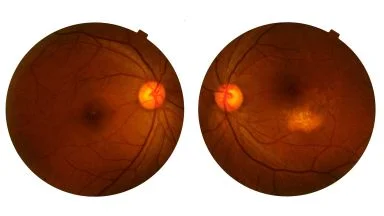
- La CNV miopica (crescita di vasi anomali che perdono sangue a livello della porzione posteriore dell’occhio quale complicanza della miopia elevata) spesso causa un deterioramento irreversibile della visione centrale
La Commissione Europea ha riconosciuto una nuova indicazione per ranibizumab per il trattamento dei pazienti con compromissione della vista causata da neovascolarizzazione coroideale (CNV) secondaria a miopia patologica (CNV miopica).
Questo rende ranibizumab la prima terapia anti-VEGF autorizzata per quattro indicazioni nell’Unione Europea.
La miopia patologica colpisce spesso gli adulti in età lavorativa ed è una delle principali cause di perdita della vista in tutto il mondo: interessa, infatti, l’1-3% della popolazione1,2.
La CNV è la complicanza più diffusa e pericolosa in termini di riduzione della capacità visiva della miopia elevata 3.
Nei pazienti affetti da CNV miopica non trattata la prognosi a lungo termine è sfavorevole con il 90% circa dei pazienti affetti che sviluppa una grave perdita della vista dopo cinque anni.
La perdita visiva derivante dalla CNV miopica, che di solito colpisce le persone prima dei 50 anni, ha un forte impatto sull’attività lavorativa, le aspettative di carriera e la qualità della vita di soggetti in età lavorativa.
Il trattamento della CNV miopica inizia con una singola iniezione. Eventuali ulteriori iniezioni si basano su un regime personalizzato.
RADIANCE, lo studio clinico condotto nei pazienti con CNV miopica, dimostra che ranibizumab fornisce un rapido miglioramento dell’acuità visiva risultando superiore in termini di efficacia rispetto all’attuale terapia standard autorizzata, Visudyne® (verteporfina PDT).
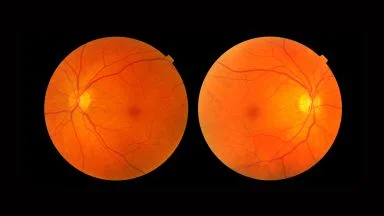
Con una media di due sole iniezioni, nel primo anno si evidenzia un miglioramento medio dell’acuità visiva di 14 lettere e oltre il 60% dei pazienti dello studio RADIANCE non ha avuto bisogno di ulteriori iniezioni dopo 6 mesi5.
Dopo una sola iniezione di ranibizumab sono stati ottenuti rapidi miglioramenti dell’acuità visiva e oltre il 70% dei pazienti trattati con ranibizumab nell’ambito dello studio RADIANCE ha sperimentato una riduzione della diffusione di liquidi dai vasi anomali generati dalla CNV e di conseguenza una riduzione dell’edema maculare intraretinico, con una concomitante significativa riduzione dello spessore retinico centrale già a partire dal primo mese.
Ranibizumab ha un profilo di sicurezza ben consolidato: durante lo studio RADIANCE il profilo di sicurezza è stato coerente con quello osservato in altri studi, così come con quello derivato dall’esperienza in real world; inoltre non è stato identificato alcun nuovo rischio per la sicurezza oculare/non oculare.
Ranibizumabè un frammento di anticorpo umanizzato progettato per bloccare tutte le forme biologicamente attive del fattore di crescita dell’endotelio vascolare di tipo A (VEGF-A). Aumenti dei livelli di VEGF-A sono stati osservati nella degenerazione maculare correlata all’età in forma umida (wAMD) e in altre patologie oculari, come l’edema maculare diabetico (DME) e l’occlusione venosa retinica (RVO). Ranibizumab è stato specificamente progettato per l’uso oftalmico, il che riduce al minimo l’esposizione sistemica.
Ranibizumab è autorizzato per il trattamento della degenerazione maculare senile umida (wAMD) in oltre 100 Paesi, in oltre 90 Paesi per il trattamento della compromissione visiva causata da DME EDEMA MACULARE DIABETICO e in 90 Paesi per la disabilità visiva causata da edema maculare secondario a RVO, sia centrale che di branca.
In molti Paesi, compresi quelli europei, ranibizumab presenta un regime di trattamento individualizzato, con l’obiettivo di massimizzare i risultati sulla visione, riducendo al minimo il sotto- o sovra-trattamento dei pazienti.
Ranibizumabha un profilo di sicurezza ben consolidato, supportato da 43 ampi studi clinici e dall’esperienza in real world.
Il suo profilo di sicurezza è stato ben documentato in un programma di sviluppo clinico che ha coinvolto più di 12.500 pazienti tra le varie indicazioni.
Bibliografia essenziale
- Silva R et al. Myopic maculopathy: A review. Ophthalmologica 2012;228:197-213.
- Shi Y et al. Exome sequencing identifies ZNF644 mutations in high myopia. PLOS Genet 2011;7: e1002084.
- Neelam K et al. Choroidal neovascularization in pathological myopia. Prog Retin Eye Res 2012;31:495-525.
- Yoshida T et al. Myopic choroidal neovascularization: a 10-year follow-up. Ophthalmology 2003;110:1297-1305.
- Bandello F. Twelve-month efficacy and safety of ranibizumab 0.5 mg versus verteporfin photodynamic therapy in the treatment of visual impairment due to choroidal neovascularization secondary to pathologic myopia. Association for Research in Vision and Ophthalmology 2013.