La chirurgia protesica di spalla
La chirurgia protesica di spalla è una “chirurgia giovane”. Il motivo che l’interesse per la spalla sia arrivato più tardi è dovuto alla capacità che ha quest’ articolazione ad adattarsi a condizioni molto complesse e non ideali quale conseguenza di fratture della parte prossimale dell’omero. Nel futuro la tecnologia ci metterà a disposizione materiali e strumenti sempre più raffinati che elimineranno tutti i problemi attuali ma consentiranno anche di ottenere miglioramenti sia sul piano chirurgico dei risultati sia della qualità dei materiali utilizzati.
Introduzione
 La chirurgia protesica di spalla è una “chirurgia giovane”. La storia racconta di primi impianti di protesi articolari sperimentati e attuati già molti anni prima per l’anca e per il ginocchio.
La chirurgia protesica di spalla è una “chirurgia giovane”. La storia racconta di primi impianti di protesi articolari sperimentati e attuati già molti anni prima per l’anca e per il ginocchio.
Il motivo che l’interesse per la spalla sia arrivato più tardi è dovuto alla capacità che ha quest’ articolazione ad adattarsi a condizioni molto complesse e non ideali quale conseguenza di fratture della parte prossimale dell’omero.
Cenni di storia
L'11 marzo 1893 il Dr. Jules Emile Péan fu il primo chirurgo ad effettuare la prima protesi di spalla presso l’ “International Hôpital” a Parigi. Consapevole che la grandezza degli uomini è nel riconoscere i propri limiti, Péan, nel suo rapporto originale, dichiarò che si era ispirato al lavoro di Temistocle Gluck che il 20 maggio 1890 impiantò la prima protesi totale di ginocchio vincolata. Pertanto si può affermare che il Dr. T. Gluck fu ilpioniere della protesica di ginocchio mentre il Dr. J.E. Péan fu il pioniere della protesica di spalla.La sua prima protesi di spalla, Péan l’impiantò a un paziente affetto da TBC di spalla e fu costruita assieme ad un dentista di Parigi – un certo Michaels - in platino con testa di gomma. Péan riuscì nel suo intento poiché il paziente aveva rifiutato la disarticolazione della spalla. Il risultato di tale impianto non fu positivo poiché dopo soli 15 giorni il paziente presentò una fistola che si complicò in una severa infezione tale da imporre la rimozione della protesi. Ciò non scoraggiò ma influì enormemente nel percorso di migliorare la tecnica.
Nel 1913 Il Dr. F. Konig, chirurgo tedesco, sperimentò un tipo di protesi di spalla utilizzando un blocco di avorio. Pur effettuando un mirabile intervento, purtroppo, il risultato fu deludente.
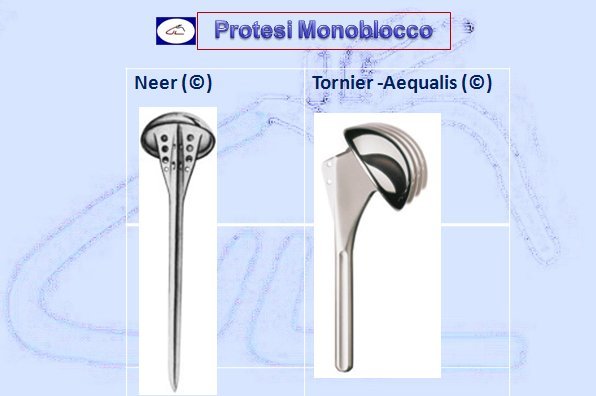
Solo nel 1953 con il Dr. Charles Neer (Scuola Statunitense Columbia Presbyterian di New York-USA) comincia l’era moderna nella protesica di spalla. Egli realizzò una protesi in Vitallium (lega cromo-cobalto) a scivolamento monoblocco con requisiti essenziali per funzionare ovvero era indispensabile una cuffia dei rotatori integra o almeno riparabile. La protesi di Neer può essere chiamata “ENDOPROTESI” poiché prevedeva solo la sostituzione della componente omerale. Neer descrisse i suoi primi casi utilizzando la sua protesi nelle fratture dell’estremo prossimale dell’omero. Nel 1955, Neer pubblicò un lavoro scientifico dove riportava la sua esperienza di 12 protesi (7 fratture lussazioni e 5 fratture inveterate). Nel 1964 pubblicò i risultati ottenuti su 54 pazienti affetti da frattura ed il disegno protesico era previsto ad incastro o press-fit.
Nel 1970 il Dr. John Charnley, noto chirurgo britannico nonché altro grande pioniere della chirurgia protesica dell’anca, introdusse un concetto fondamentale nella protesica e cioè la compressione ossea. Grazie a lui fu sperimentato un nuovo elemento per la fissazione dell’impianto protesico: il cemento acrilico in sostituzione delle viti. Con Charnley si modificò anche l’impianto protesico soprattutto per la componente glenoidea che veniva protesizzata anch’essa , nacque così l’ “ARTROPROTESI”.
Nel 1974 il Dr. Charles Neer comprese che per eliminare il dolore post chirurgico ed ottenere una buona funzione della spalla era necessario protesizzare anche la glena utilizzando il polietilene con cemento acrilico; più tardi pubblicò la sua esperienza su 48 pazienti affetti da artrosi gleno-omerale suggerendo, pertanto, anche la sostituzione della glena cementata ed estendendo l’indicazione alla patologia infiammatoria.
Nel 1980 furono proposti “steli modulari” e glena in “metal back + polietilene” senza necessità di cementazione aprendo la strada a nuove proposte terapeutiche.
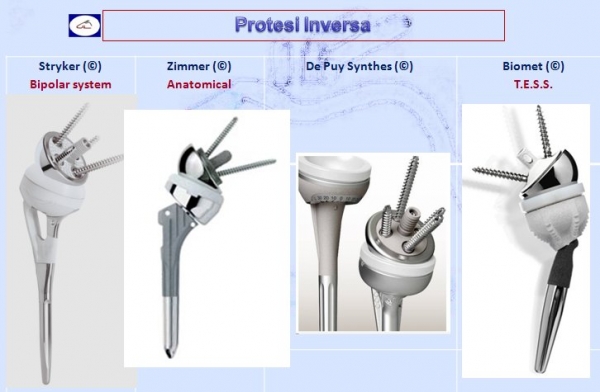
Nel 1985, il Dr. Paul Grammont, noto chirurgo francese, progettò una protesi unica, indicata a quei pazienti che, pur affetti da artrosi alla spalla, non avevano una cuffia dei rotatori funzionante. Questo nuovo progetto di protesi aveva un design totalmente innovativo rispetto al passato poiché invertiva il rapporto anatomico normale della spalla. Infatti veniva invertito completamente il rapporto anatomico in quanto il progetto prevedeva una superficie a “palla”della glena ed una superficie piatta della testa. Per tale motivo fu dato il termine di “protesi Inversa” a tale tipo di protesi. La protesi di Grammont consiste nell’impiantare una protesi a superficie convessa nella glena ed una protesi a superficie concava al posto della testa omerale. Questo concetto rivoluzionario invertiva completamente il sistema concavo-convesso della spalla offrendo la possibilità di ottenere non solo il sollievo dal dolore ma anche quello di migliorare il movimento (ROM) della spalla anche in quei pazienti che non avevano una cuffia dei rotatori funzionante.L’obiettivo che Grammont si era proposto di ottenere era quello di medializzare la forza di reazione articolare in modo da aumentare il braccio di forza del deltoide, permettendo così al muscolo di elevare l’arto.
Nel 1986, il Dr. Stephen A. Copeland comincio a sperimentare una nuova protesi che chiamò: “Surface Replacement Arthroplasties” ovvero una protesi di sostituzione di superficie. Il suo lavoro durò 10 anni fino al 1997 ed applicò la sua tecnica per: l'osteoartrosi, l’ artrite reumatoide, l’ artropatia da instabilità, l’ artropatia postraumatica ed anche l’ artropatia da lesione della cuffia dei rotatori. I risultati migliori, fino al 93%, furono solo per l’artrosi primaria.
Le protesi di spalla
L’espansione tecnologica degli ultimi anni ha prodotto miglioramenti nello sviluppo di nuovi materiali protesici da utilizzare in ortopedia ma ha anche perfezionato e minimizzato la tecnica chirurgica della protesizzazione di spalla.
Qui di seguito, sono riportati solo alcuni dei tantissimi modelli di protesi di spalla in commercio, differenziate nelle varie caratteristiche tecniche.
A parte viene considerato un elemento di supporto alle protesi che è il cemento acrilico. Questo si comporta come una malta (una sorta di calce) che permette il fissaggio protesico. Questo si attua per l’interdigitazione del cemento all’interno dell’osso spongioso; tale procedimento distende i carichi trasmessi dalla protesi sulla più ampia superficie ossea possibile.
Le protesi di spalla si suddividono in:
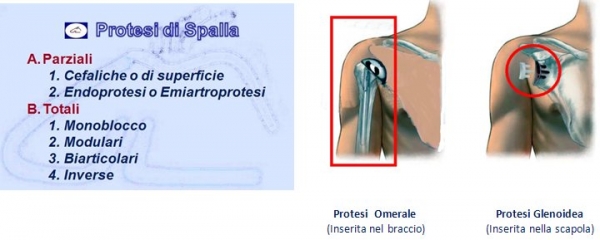
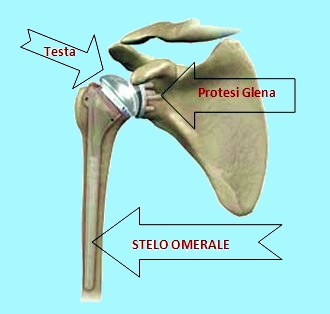
Le protesi parziali – chiamate anche endoprotesi o emiartroprotesi – hanno la caratteristica di sostituire chirurgicamente solo la testa omerale interfacciandosi con la superficie anatomica della glena della scapola.Queste protesi mantengono, per lo più, la stessa anatomia della testa e cioè emisferica oppure 1/3 di sfera (Neer I e Neer II). La componente cefalica, la testa emisferica per intenderci, è solidale con lo stelo protesico formando un solo pezzo.
Le protesi totali sono caratterizzate dal fatto che oltre alla sostituzione della testa omerale viene impiantata una protesi anche sulla glena della scapola. Tale protesizzazione glenoidea può essere di solo Polietilene (Polimero sintetico) oppure con un supporto di metallo (Metal Back).
Vi sono vari modelli in commercio a seconda della patologia da trattare ma la più caratteristica è la protesi inversa che ribalta il principio anatomico che prevede la glena piatta e la testa omerale emisferica mentre in questo modello protesico è proprio il contrario. Inizialmente la protesi inversa era proposta solo in caso di rottura della cuffia dei rotatori oggi, invece, viene utilizzata anche per fratture pluriframmentarie dell’epifisi prossimale, nelle pseudoartrosi, nelle consolidazioni viziose ma anche nell’artrite reumatoide, nei tumori.
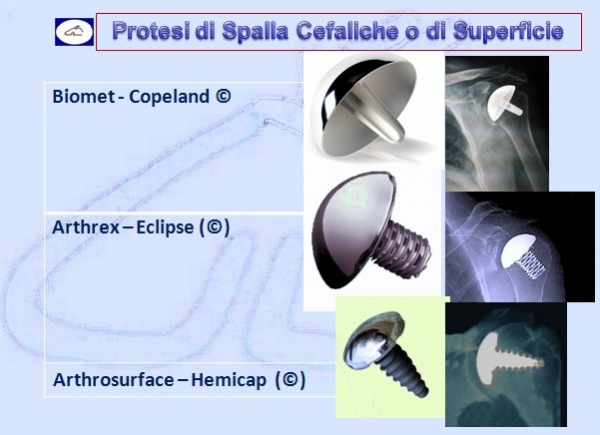

Indicazioni
Le attuali indicazioni sono subordinate a un severo criterio di scelta sia del paziente sia del modello di protesi da impiantare, ma quest’argomento lo affronteremo nel paragrafo successivo.
Al momento di scegliere la via chirurgica di un impianto protesico, il chirurgo deve saper valutare bene quelle che sono le finalità di tale indicazione terapeutica, e cioè:

Anche se questi tre principi sono stati rispettati nella protesica di anca e di ginocchio, purtroppo non sono costanti nella protesica di spalla.
Le indicazioni principali sono elencate nel seguente quadro sinottico:

Criteri selettivi di scelta
Prima di impiantare una protesi di spalla, sono indispensabili alcuni criteri di selezione:
- Scelta dei pazienti da trattare
- Scelta del modello di protesi più indicata
Oggi si pone molta attenzione a informare il paziente (consenso informato) in modo completo ed esaustivo al fine di trasferire tutte le informazioni possibili affinché raggiunga quella consapevolezza del tipo di intervento chirurgico che sta per accettare. Pertanto, nel raggiungimento degli obiettivi prestabiliti, il chirurgo saprà tener conto di questi parametri:
a) Informazione - Oltre che informare il paziente su cosa gli si propone, è fondamentale informarlo anche su tutte le implicazioni che tale tipo di intervento chirurgico comporta. Il dialogo con il paziente consente di acquisire almeno due informazioni importanti: 1) una reale e concreta motivazione 2) la disponibilità ad accettare qualsiasi risultato. Proprio su quest’ultimo punto vorrei sottolineare quanto importante sia “passare” al paziente il concetto che i risultati non sono prevedibili pertanto si possono ottenere anche risultati non particolarmente corrispondenti a quanto desiderato.
b) Biomeccanica articolare - Nell’elaborare il “planning preoperatorio”, che consiste in una valutazione di tutte quelle condizioni che sono necessaria al buon fine del risultato finale, il chirurgo valuta sia l’aspetto radiografico (RDX, TC, RM, ecc.) ma anche le valide condizioni della muscolatura del cingolo scapolare escludendo gravi sofferenze come la spalla neurologica, la paralisi o un grave danno del deltoide.
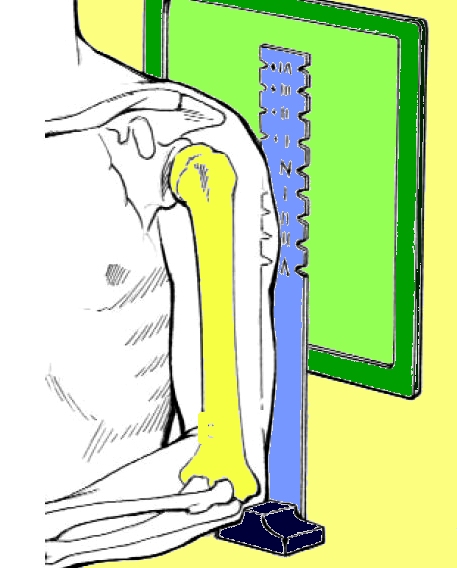
Esame radiografico spalla contro laterale
(utilizzo di una squadra per le misurazioni anatomiche)
c) Riabilitazione - Dopo un intervento di protesi di spalla, anche se eseguito in modo perfetto, è fondamentale la fase successiva di riabilitazione; il chirurgo informa il paziente che il risultato finale dipende anche da come egli affronta tutto il percorso riabilitativo postoperatorio; questo è un dato essenziale poiché conoscere prima dell’intervento chirurgico che il paziente è poco disponibile ad un protocollo riabilitativo può compromettere anche di molto il risultato finale.
La scelta della protesi adatta per quel paziente è un elemento indefettibile.
Abbiamo visto quanto attualmente la tecnologia offre ampie possibilità di scelta del modello protesico da impiantare. Nonostante siano a disposizione del chirurgo molte possibilità di scelta sia nella forma sia nelle caratteristiche, la preferenza di una protesi rispetto ad un'altra è condizionata dalla patologia di cui è affetto il paziente.
A) Nella patologia degenerativa primaria (Osteoartrosi Primitiva Concentrica)
L’artrosi gleno-omerale della spalla è una patologia poco frequente e rappresenta solo il 3% di tutta la popolazione di pazienti affetti da artrosi. Si è già detto che l’artrosi si divide in primaria (concentrica) e secondaria (eccentrica). In questi casi, dopo aver effettuato le procedure di rito: anamnesi accurata, valutazione funzione muscolare, studio radiologico preoperatorio, acquisizioni neuro-psicologiche del paziente, si stabilisce il tipo di protesi adeguato.
La scelta del modello protesico può essere:
- Protesi monoblocco (unico pezzo comprendente lo stelo e la testa omerale)
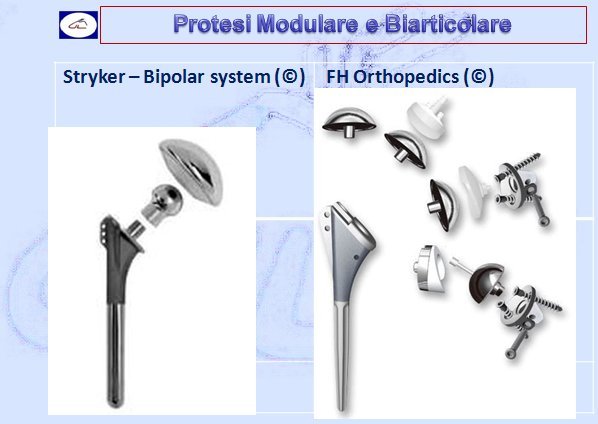
- Protesi modulari (più pezzi modulabili e interfacciabili)
- Protesi biarticolari (più pezzi con stelo, testina e cupola)
- Protesi totali o artroprotesi (comprendenti la parte omerale della testa e quella della glena della scapola)
B) Nella patologia degenerativa secondaria (Osteoartrosi Secondaria Eccentrica)
L’osteoartrosi eccentrica è di solito associata ad una rottura della cuffia dei rotatori (CDR) e quindi quale conseguenza di un conflitto subacromiale con i relativi problemi annessi a tale patologia. Questo tipo di degenerazione progredisce quasi nella totalità dei casi verso una grave artropatia distruttiva. Sono caratterizzate da tre gruppi. Gruppo 1: inquadrabili in una forma definita “cuff arthropaty” come descritta da Neer, caratteristica è la grave evoluzione verso un progressivo coinvolgimento della testa omerale, della glena e del tetto acromiale fino ad una vera e propria lisi dell’acromion. Gruppo 2: sono quelle condizioni in cui pur essendovi una artrosi concentrica questa è accompagnata da una rottura contemporanea della cuffia dei rotatori. Gruppo 3: tipica delle artrosi secondarie ad artrite reumatoide.
In questi casi la scelta del modello protesico può essere:
- Protesi inversa
C) Nell’artrite reumatoide
Anche se oggi vi sono stati molti progressi nel trattamento di tale patologia, non è infrequente riscontrare alcuni pazienti con complicazioni a carico della spalla. In tal caso sono manifestazioni sia a carico della gleno omerale (GO) sia a carico della acromion claveare (A/C). Non vi è progressione graduale nel tempo per cui vi sono pazienti che sviluppano una compromissione del cingolo scapolo omerale dopo molto tempo come vi sono pazienti che manifestano disturbi alla spalla in maniera rapidissima. Tuttavia sono state proposte delle classificazioni di cui riporto quella di Weil (cinque stadi da “0” a “D”) e quella di Neer in tre tipi: a) forma secca b) forma umida c) forma umida con riassorbimento osseo.
In questi casi la scelta del modello protesico può essere:
- Protesi inversa con cementazione
Quando si parla di cementazione si deve intendere una componente acrilica appartenenti alle resine acriliche autoindurenti che nella fase di polimerizzazione sono dotate di proprietà plastiche. La molecola è il Polimetilmetacrilato (PMMA). Come si è detto, già nel 1960 Charnleyintroduce le protesi a basso attrito (acciaio inossidabile/polietilene) cementata, aumentando enormemente la vita media delle protesi ortopediche. Il cemento svolge una funzione importantissima cioè fissa le protesi articolari alla struttura
D) Nell’artropatia da rottura cuffia dei rotatori
Nella patologi artrosica da rottura massiva della cuffia dei rotatori l’unico muscolo che può sostituire in qualche modo è il deltoide.
In questi casi la scelta del modello protesico può essere:
- Protesi inversa
E) Nella necrosi asettica
Con questo termine si intende una condizione caratterizzata dalla morte cellulare/biologica di un segmento di osso e nello specifico della testa omerale . Le cause possono essere molte e possono dividersi in a) Idiopatiche (causa sconosciuta) e b) secondarie (per terapia cortisonica, postraumatica, da alcoolismo, iatrogena, ecc.).
E’ stata proposta una classificazione in cinque stadi da Cruess che prospetta tale suddivisione a seconda delle ripercussioni biologiche del tessuto osseo. Alcuni autori restano perplessi su alcuni punti di scelta terapeutica di protesizzazione ma fondamentalmente un solo punto unisce tutti nelle controindicazioni assolute e cioè quando l’ostenecrosi è in fase di infezione attiva, e nelle controindicazioni relative e cioè nelle deficienze del deltoide, della cuffia dei rotatori e nelle artropatie neuropatiche. Nella necrosi asettica la scelta del modello protesico può essere:
- Protesi modulari
- Protesi totali o artroprotesi
- Protesi inversa
La protesi di Grammont è oggetto di molte controversie e le scuole si dividono sull’uso di tale metodica. Fortemente dibattuto è anche l’uso del cemento che viene consigliato, quando si sceglie questo tipo di opportunità, solo a pazienti non più giovani.
F) Nell’artrosi settica
Può sembrare contraddittorio la scelta di protesizzare questi pazienti visto che si è parlato di stato settico quale situazione che controindica tale intervento. Anche se un tempo l’artrite settica rappresentava una reale controindicazione, le attuali esperienze nella riprotesizzazione dell’anca e del ginocchio dopo infezioni, è stata aperta la strada anche alla spalla. Indispensabile la scelta dei pazienti da protesizzare poiché questi debbono assolutamente superare il blocco costituito dalla scomparsa dei segni clinici e strumentali di infezione.
Nell’artrosi settica la scelta del modello protesico può essere:
- Protesi modulari
- Protesi totali o artroprotesi
- Protesi inversa
Quando si prevede l’uso di cemento, questo deve essere arricchito con antibiotici. Oggi vi sono molte ditte che producono cemento più antibiotico.
G) Nell’artrite da lussazione
In questi casi si può sviluppare un’artrosi per due motivi: a) esiti distruttivi dell’articolazione da lussazione cronica recidivante b) esiti iatrogeni di interventi chirurgici riparativi di lussazione di spalla. In questi casi la scelta varia a discrezione del chirurgo
H) Nei traumi acuti e inveterati
Nonostante le fratture della parte prossimale dell’omero (quella della testa per intenderci) rappresentino solo il 5-6% di tutte le fratture vi sono casi in cui la sintesi con chiodi e placche non è possibile e pertanto si ricorre alla protesi. Il picco maggiore si riscontra nei pazienti di media età o maggiori con un percentuale femminile più colpita rispetto a quella maschile. Le fratture che richiedono il trattamento con protesi appartengono ad una categoria particolare di frammentazione della testa omerale e/o complicazioni secondarie mentre in assoluto sono controindicate nelle fratture esposte e quelle infette.
La scelta del modello protesico può essere:
- Protesi modulari
- Protesi totali o artroprotesi
- Protesi inversa
Complicanze
Anche se la storia della chirurgia protesica della spalla non è ricca di successi, negli ultimi anni i risultati sono migliorati moltissimo. Ciò è dovuto sia ai progressi della tecnica sia ai rigorosi criteri di scelta che hanno consentito di porre una più mirata indicazione.
Sono stati proprio gli insuccessi che, invece di scoraggiare, hanno fatto in modo da individuare i motivi del fallimento e migliorare la tecnica e i materiali.
Il risultato è che negli ultimi anni, molti pazienti hanno visto risolto i loro problemi di dolore e/o di mobilità della spalla grazie alla chirurgia protesica.
La percentuale di complicanze dopo una protesi di spalla è bassa. Bisogna distinguere tra:
A) Complicanze generali
- Tromboemboliche: Queste accadono nonostante sia stata instaurata la profilassi antitromboembolica; in letteratura le casistiche riportano una frequenza di trombosi venosa profonda nel 5,7% e di tromboembolismo polmonare nel k 2,9 % .
- Ictus cerebrale (0,1%)
- Infarto miocardico (0,1%)
B) Complicanze locali
- Mobilizzazione componente protesica (Glenoidea o Stelo omerale) - Questo tipo di complicanza si presenta in maniera diversa a seconda della componente poiché si passa dal 2-3% della componente omerale fino ad arrivare al 30-90% della componente glenoidea.
- Scollamento delle componenti protesiche
- Erosioni glenoidee
- Rottura della cuffia dei rotatori
- Fratture ossee intraoperatorie
- Fratture dell’impianto protesico
- Lesioni vascolari e nervose
- Infezioni
- Ossificazione ectopica
- Instabilità
- Rigidità articolare
Controindicazioni
Premesso che sono stati già descritti i rigorosi criteri di scelta del paziente ma altrettanto rigorosi criteri di scelta della protesi giusta da impiantare, non sono da trascurare quelle condizioni cliniche e anatomopatologiche che individuano controindicazioni assolute all’intervento di protesi e che il chirurgo della spalla deve tener sempre presente.
Le condizioni cliniche e anatomopatologiche che rappresentano assoluta controindicazione all’intervento sono:

Quale futuro
Si è scritto tantissimo sul futuro della protesica di spalla.
Gli schieramenti si dividono in due fronti, c’è chi si pone in maniera molto critica nei confronti di tale chirurgia ma c’è anche chi, come me, è ottimista nello sviluppo sempre maggiore di tale chirurgia.
Non si può non ammettere l’invecchiamento della popolazione. Il futuro della chirurgia ortopedica non può prescindere dal prendere in considerazione il maggior numero di persone che potrà soffrire di fratture dell’estremità prossimale dell’omero e della patologia artrosica delle persone più anziane.
Il medico non può sottrarsi a questo evento storico rinunciando, a priori, solo per gli attuali limiti tecnici e strumentali.
Ritengo che in futuro la tecnologia ci metterà a disposizione materiali e strumenti sempre più raffinati che elimineranno tutti i problemi attuali ma consentiranno anche di ottenere miglioramenti sia sul piano chirurgico sia dei materiali utilizzati.
Come sempre, Il futuro è nelle nostre mani. Come recita un noto aforisma … “Da soli si va solo più veloci ma insieme si va più lontano”.
Bibliografia
- Amstutz H.C.; Sew Hoi A.L. and Clarke I.C.: Anatomic Total Shoulder. Clinic. Orthop., 155: 7-20, 1981.
- Amstutz H.C.; Thomas B.J. and Kabo J.M. et al.: The Dana total shoulder Arthoplasty. J. Bone and Joint Surg., 70-A: 1174-1182, 1988.
- Bade H.A. III; Warren R.F.; Ranawat C. and Inglis A.E.: Long Term Result of Neer Total Shoulder Replacement . In Bademan J.E. and Walsh R.P. (Eds) : Surgery of the Shoulder . St Louis: CV Mosby Company, 294-302, 1984
- Barret W.P; Franklin J.L. and Jackins S.E. et al.: Total Shoulder Arthoplasty. J. Bone and Joint Surg., 69-A: 865-872, 1987.
- Barret W.P.; Thornhill T.S.; Thomas W.H. ; Gebhart E.M. and Sledge C.B.: Non Constrained Total Shoulder Arthoplasty in Patients with Polyarticular Rheumatoid Arthritis. J of Arthoplasty, 4: 1: 91-96, 1989.
- Boileau P.: La Prothese d’Epaule de Neer: Resultats en Fonction de l’Etiologie. Journées Lyonnaises de l’Epaule, 140-162, aprile1993.
- Boileau P.; Walch G and Liotard J.P.: Etude Radio-Cinématographique de l’Elevation Active de l’Epaule Prothésée . Rev. Chir. Orthop., 78: 355-364, 1992.
- Boyd A.D.; Thomas W.T.; Scott R.D.; Sledge C.B. and Thornhill T.S.: Shoulder Arthoplasty Versus Hemiarthoplasty. Indication for Glenoid Resurfacing . J. of Arthoplasty, 55: 4: 329-336, 1990.
- Burgess DL, McGrath MS, Bonutti PM, et al.Shoulder resurfacing. J Bone Joint Surg Am2009;91:1228-38.
- Shrivastava N, Szabo RM. Copeland EAShemi-resurfacing arthroplasty for rotator cufftear arthropathy: preliminary results. J ShoulderElbow Surg 2008;17:863-70.
- G. Cerciello, D. Rossetti, G. ConteAsl “RM-E”, Polo ospedaliero integrato S. Spirito“Villa Betania”, U.O.C. di Chirurgia della spallae del Ginocchio: Le protesi di superficiee le endoprotesi dolorosedi spalla – GIOT agosto 2012;38 (supl. 2): 165-167
- Dati del Ministero della Sanità – 2005.
- V. De Cupis, M. Palmacci, C. Chillemi, A. Todesca -ICOT LATINA: Cuff arthropaty: trattamento con protesi inversa – Acta Orthopedica Italica 2004 Vol. 31
- Gonzales JF, Alami GB, Baque F, et al. Complicationsof unconstrained shoulder prostheses.J Shoulder Elbow Surg 2011;20:666-82.
- Grammont P, Trouilloud P, Laffay JP, Deries X. Etude et réalisation d’une nouvelleprothèse d’épaule. Rheumatologie 39 (10): 407-418, 1987
- Levy O, Williams H, Bruguera J, et al. Cementlesssurface replacement arthroplasty ofthe shoulder – 11 years experience. ICCS,1998 Sydney.
- Levy O, Mullett H, Roberts S, et al. The roleof anterior deltoid reeducation in patientswith massive irreparable degenerativerotator cuff tears. J Shoulder Elbow Surg2008;17:863-70.
- Levy O, Copeland SA. Résultats des prosthesesde resurfacage dans l’omarthroseprimitive et l’arthrite rhumatoide. In: Prothèsesd’épaule. Etat actuel. Chaiersd’enseignement de la SOFCOT, ElsevierMasson 2008:232-42.
- McFarland E. G., Srikumaran U., Freehill M. T., Pannirselvam V., Petersen S. A.: Indications forreverseshoulder prosthesis - Division of Shoulder Surgery Department of Orthopaedic Surgery The Johns Hopkins University, Baltimore, MD, USA
- Miller BS, Joseph TA, Noonan TJ, et al.Rupture of the subscapularis tendon aftershoulder arthroplasty: diagnosis, treatment,and outcome. J Shoulder Elbow Surg2005;14:492-6.
- Namba RS, Thornhill TS. Posterior capsulorraphyin total shoulder arthroplasty. A case report.Clin Orthop Relat Res 1995;313:135-9.
- Neer CS, Craig EV, Fukuda H. Cuff-tear arthropathy. J Bone Joint Surg Am 1983;65:1232-44
- Neer CS. Replacement arthroplasty for glenohumeralosteoarthritis. J Bone Joint SurgAm 1974;56:1-13.
- Parson IM, Millet PJ, Warner JJ. Glenoidwear after shoulder hemiarthroplasty: quantitativeradiographic analysis. Clin OrthopRelat Res 2004;421:120-5.
- Porcellini G; Castagna A.; Campi F.; Paladini P.: La spalla. Verduci Editore 2003
- Pritchett JW. Long-term results and patient satisfactionafter shoulder resurfacing. J ShoulderElbow Surg 2011;20:771-7.
- Raj D, Mullet H, Even T, et al. Hydroxyapatite-coated Copeland surface replacementarthroplasty. Long term fallow-up.Presented at 19th Congress of the EuropeanSociety for Surgery of the shoulderand Elbow (ESSE) Rome, Italy, September21-24, 2005.
- Versier G, Marchaland JP, Basso M, etal. Resultats cliniques et radiologiquesdes prothéses d’épaule sur ostéonecroseaseptique de la tete humérale. Mémoiresde l’Academie Nationale de chirurgie2004;3:1-7.
- Sanchedz-Sotelo J, Sperling JW, RowlandCM, et al. Instability after shoulder arthroplasty:results of surgical treatment. J BoneJoint Surg Am 2003;85-A:622-31.
- Sperling JW, Cofield RH. Revision totalshoulder arthroplasty for the treatment ofglenoid arthrosis. J Bone Joint Surg Am1988;80:860-7.
- Walch G, Boileau P. Morphological study ofthe humeral proximal épiphisis. J Bone andJoint Surg Br 1992;74:14.